NRIは2010年に「SAP
HANA」を世界に先駆けて導入に成功し、さらに2015年にはクラウド空間(Amazon
Web Service:AWS)上に実装した「SAP
AFS」が世界最高のSAP処理性能を達成し、その技術力が一躍グローバルで注目されることとなった。翌2016年には「SAP
S/4HANA」を国内初稼働させ、新たな技術標準をリードする役割を担った。
ERPが持つエンタープライズレベルのビジネス情報の集約が、経営・事業のマネージメントの遂行に重要である一方、さまざまなクラウドサービスの活用が、業務オペレーションのデジタル化を推進し、それにより業務効率の向上や業務全体の円滑化が図られることも着目すべきである。
これらERPとクラウドサービスのインテグレーションは、NRIの持つマルチクラウド技術と相まって、企業の求める全社に亘る改革の実現に大きく寄与している。
【特集】S/4 HANAへの道 :戦略的移行を成功に導く3つの要諦
~業務改革・アドオン撲滅をリビルドにて同時に実現~
デジタル・クラウド時代に対処すべき2つのアーキテクチャ刷新
国内の企業経営者が経営戦略としてのデジタル活用を本格化させている。これは、弊社のコンサルティング部門向けのご相談内容からも顕著に表れており、これまでの調査段階から実行段階に移行しつつある。また、これまでのIT活用の業務改革テーマと比較すると、営業フロントや生産・物流の「現場」を起点としていることに特徴がある。ビジネスの末端となる各現場から、コアとなる業態変革まで、ビジネスアーキテクチャの刷新が図られているのである。
一方、SAP S/4HANAをクラウド空間上のデジタルソリューションのプラットフォームとして導入し、エコシステムと共生を図るというSAP社の戦略転換が、昨年あたりより本格化してきた。これは、従来のレガシー脱却という消極的なITアーキテクチャ刷新テーマに対して、デジタル戦略のプラットフォームを備えるという戦略的意味合いを含んでいる。昨年の一般社団法人日本情報システム・ユーザー協会(JUAS)と株式会社野村総合研究所の共同調査「デジタル化の取り組みに関する調査」(https://juas.or.jp/cms/media/2020/05/Digital20_ppt.pdf)においても、レガシーシステムの存在をデジタル化の対応の足かせと感じる企業が約77%という結果が出ており、レガシー脱却の意思決定が急がれる。
ビジネスアーキテクチャとシステムアーキテクチャという、上記2点のアーキテクチャ刷新はデジタル活用における必須条件とは必ずしもならない。デジタル技術の進展やエコシステムの市場成長を鑑みると、デジタル活用は単発的なプロジェクトではなく、持続的なデジタル活用推進活動(デジタルジャーニー)の継続であり、有効なビジネスプラットフォームの備えが求められる。
デジタル戦略から見たECC→S/4 HANA移行
2000年代から本格化したSAP ECC導入時に、「経営層が求めるアドオンゼロ vs 現場のレガシーシステムのサービス継続」という課題にどう対処すべきか、葛藤を経験した企業も多いのではないだろうか。各現場の業務効率化のために作り込まれたビジネスロジックの継続が、アドオンとして作り込まれたケースも多いと聞く。アドオンというシステム資産は、維持管理コストや属人化等の課題があるため、レガシーシステムの維持と同等の将来へのリスクを含んでいる。また、標準インタフェースを覆う独自ロジックや独自データが、クラウドサービスとの親和性の阻害要因ともなりうる。効率化のために作り込まれた業務とロジックが、効率化のためのデジタル導入を遠ざけかねないという皮肉な状況を生んでいる。
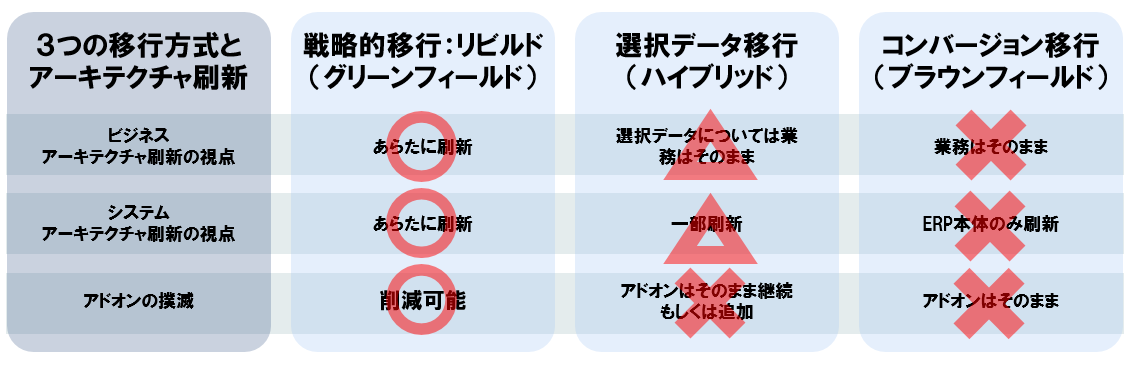
SAP社ではECCからS/4 HANAへの移行に関して様々な移行ツールを用意しており、目的に応じた3つの移行方式を推奨している。
①コンバージョン移行(ブラウンフィールド)
コンバージョンツールによってデータ・設定・アドオン等を、そのまま移行。業務・アドオンについても原則そのまま継続。
②選択データ移行(ハイブリッド)
複数社のシステム統合やレガシーからの機能取り込み等、データ・設定・アドオンを活用しながら別形態にて実装。現行業務やアドオン等は原則そのまま移行される。全社レベルのシステムアーキテクチャの刷新が目的となる。
③戦略的移行(グリーンフィールド)
個別に作り込まれた業務を標準化しシステム統合するケースや、業務の見直し、アドオンの撲滅等、新規のS/4 HANAに対して新たな業務設計を実施する。全社レベルのビジネスアーキテクチャ、およびシステムアーキテクチャの刷新を目的とした場合の移行方式。NRIでは戦略的移行、もしくはリビルドとも呼んでいる。
戦略的移行を成功に導く3つの要諦
NRIはこれまで、さまざまなERPの新規導入やS/4 HANAへの移行、さらにバリューチェーンに関する業務改革プロジェクトを推進してきた。プロジェクトを成功に導くために実践してきた、決して外してはならない3つの要諦がある。
第一の要諦:経営の断固とした思い
「アドオンゼロ」「1年で完遂」等、断固とした思いが重要であることは言うまでもない。一方、ECC導入時も同様でありながら、実現出来なかったケースもあるだろう。デジタル戦略に基づく戦略的移行においては、業務が変わることを恐れる必要はない。なぜなら、業務を変えることがデジタル戦略の目的だからである。
第二の要諦:立ち返るべき「目的とゴール」を明らかにする
NRIにおいては「プロジェクト憲章」の立憲と公布を重視する。目的と手段の混同は往々にして陥りがちであり、システム開発そのものが目的化しかねない。あくまで目的は業務改革であり、改革のゴールの絵姿を共通のイメージとして共有することは極めて重要である。従ってA4用紙1枚程度のプロジェクト憲章の作り込みには多くの時間を割き、業務部門・システム部門・ベンダーの合意形成と徹底がプロジェクトのスタートラインとなる。
第三の要諦:0と1の間の最適解を見出す裁定プロセス
現場の業務プロセス設計において、アドオンを継続すべきか、標準機能へ業務を変更するかの判断は、葛藤の連続となる。これは、残すか残さないか0か1で判断するものではなく、代替手段や業務体制の見直しなどの代替案を徹底的に議論し、最終的に合意してアドオンを削減すべきである。これらの意思決定を図る上では、業務・システム共通の尺度をもとに評価し、合意形成を図る必要がある。アドオン撲滅に向けたこれらの工程は、ファクトの積み上げと粘り強い議論以外に近道はない。

ビジネスプロセス改革のフレームワーク
とりわけアドオン撲滅に向けては、総論賛成各論反対のスパイラルに陥ることが常態化する。正論と正論のぶつかり合いであるため、「全体最適」なる曖昧なスローガンも光を失いがちとなる。各々の立ち位置の違いが意思決定を困難にしているため、改革に対する迅速な合意形成と、意思決定を図るための共通のモノサシが必要となる。
NRIでは、次の手順で業務に関するデータフローやアーキテクチャー、施策の経済効果を整理し、一連のプロセスを「ビジネスプロセス改革のフレームワーク」として活用している。まずは、業務を構成するデータとプロセスの流れ、業務意思決定に関わる情報の依存関係や発生頻度等のビジネスアーキテクチャを整理する。さらにアドオンや外部システム等のシステムアーキテクチャも同様に行う。そして改革施策の効果を、各種コスト等の財務指標をもとに、施策の経済効果という共通の尺度を用いて合意形成を進め、意思決定を図るのである。
NRIでは、2000年前後にSCM改革のコンサルテーションにおいて、お客様の意思決定と合意形成を合理的に図るために、ビジネスプロセス改革のフレームワークを独自に開発した。改革効果を経済効果に還元し、客観的な評価を可能にした点に特徴がある。SCMの計画系業務においては、生産・物流・販売の各業務間の利害関係や不整合の裁定に多くの成果を上げた。その後、さまざまな形で応用、進化し、今日に至っている。

2025年の崖に立ち向かう
S/4 HANAへの移行をコストと捉えるか戦略投資と捉えるかは、各社が置かれた環境や経営戦略によって異なり、単純な良し悪しで判断できるものではない。しかし、昨年NRIが導入したプロジェクトでは、S/4 HANAへの移行を業務改革とともに行い、アドオンを55%削減している。ビジネス/システムのアーキテクチャを刷新し、デジタル戦略のロードマップを描くことは現実解のひとつである。S/4 HANA移行をピンチと捉えるかチャンスと捉えるかは自社のIT戦略のゴール設定次第ということだろう。
【特集】アフターコロナの働き方改革をデジタルが推進する[人事ソリューション]
コロナの緊急事態宣言をきっかけにテレワークが一気に普及したといわれる。しかしながら非対面での業務遂行は従業員の会社や業務に向けた意識(エンゲージメント)の形成に新たな課題を生みつつある。
NRIが本年5月に実施したCIO調査(2020/6/4『新型コロナウイルス影響に関するCIO調査』野村総合研究所https://www.nri.com/jp/news/info/cc/lst/2020/0604_1)によると、20,21年度に優先度を上げるIT投資テーマとして「働き方改革」が突出していることが見て取れる。ここからも新たなワークスタイル(ニューノーマル)が今後一層広がるとともに定着されていくと考えられる。(図1)

多くの企業がテレワークを継続する中、従業員からは通勤時間削減やプライベート時間の確保等のポジティブな反応が出ている。 しかしながらその一方で、上司や同僚との間の対面でのコミュニケーションが成り立たず、「顔色を伺う」という従業員の状況把握手段を失ったに等しい状態を生んでいるとの指摘もある。その結果、従業員エンゲージメントの密かなる低下が懸念され、最悪の場合に突然の業務への支障が発生する等の「目に見えないリスク」への対処が新たな課題を生みつつある。
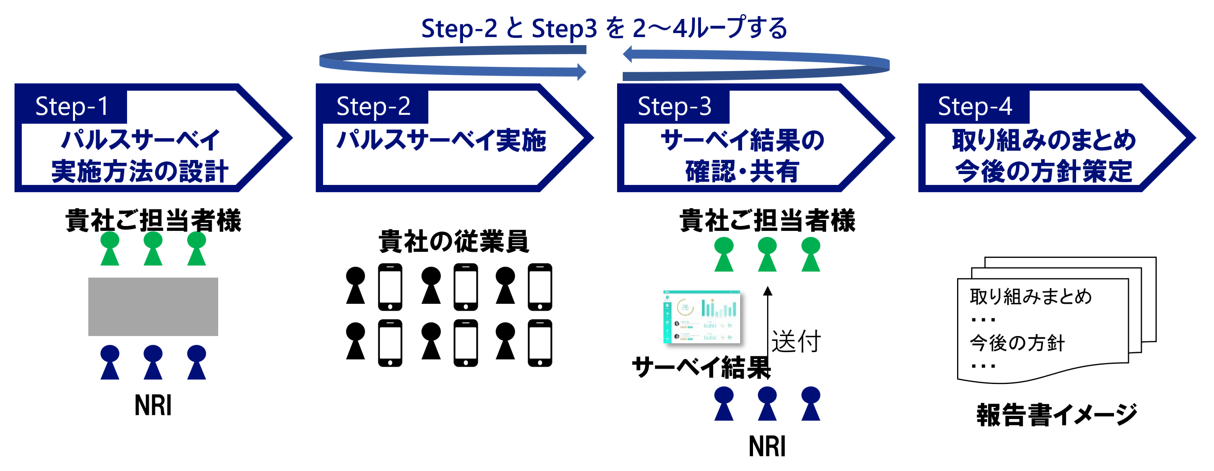
従業員エンゲージメントの変化をいち早く検出する方法論のひとつとして「パルスサーベイ」が注目されている。
パルスサーベイとは、数分で回答可能な簡易な調査を、短期間に繰り返し実施する調査手法である。これに対し、従来の大規模な調査を年に1度など長期的なスパンで行う調査手法をセンサスと呼ぶ。パルスサーベイは、センサスと異なり、従業員の詳細な状態を把握することはできないが、従業員のエンゲージメント(会社に対する愛着心)の変化をいち早く検出することが可能である。
(出処:「第285回メディアフォーラム『ITナビゲーター2020年版』」野村総合研究所 https://www.nri.com/-/media/Corporate/jp/Files/PDF/knowledge/report/cc/mediaforum/2019/forum285.pdf)
導入効果として、問題の早期解決、定点観測に基づいた施策抽出、部店間比較による状況把握等が期待できる。
弊社コンサルティング本部で実施している、パルスサーベイ コンサルティングサービスの例。(図2)
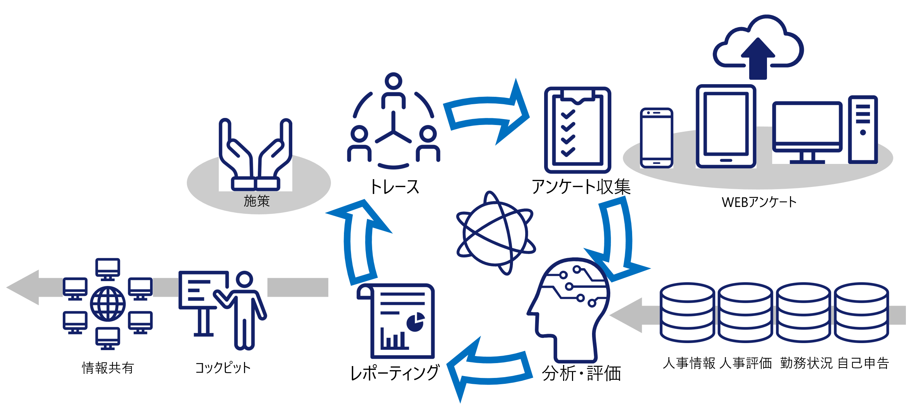
従業員エンゲージメント・マネージメントはデジタル活用によって、より円滑にかつより高度に実施することが可能となる。
パルスサーベイのデジタル活用イメージ。(図3)
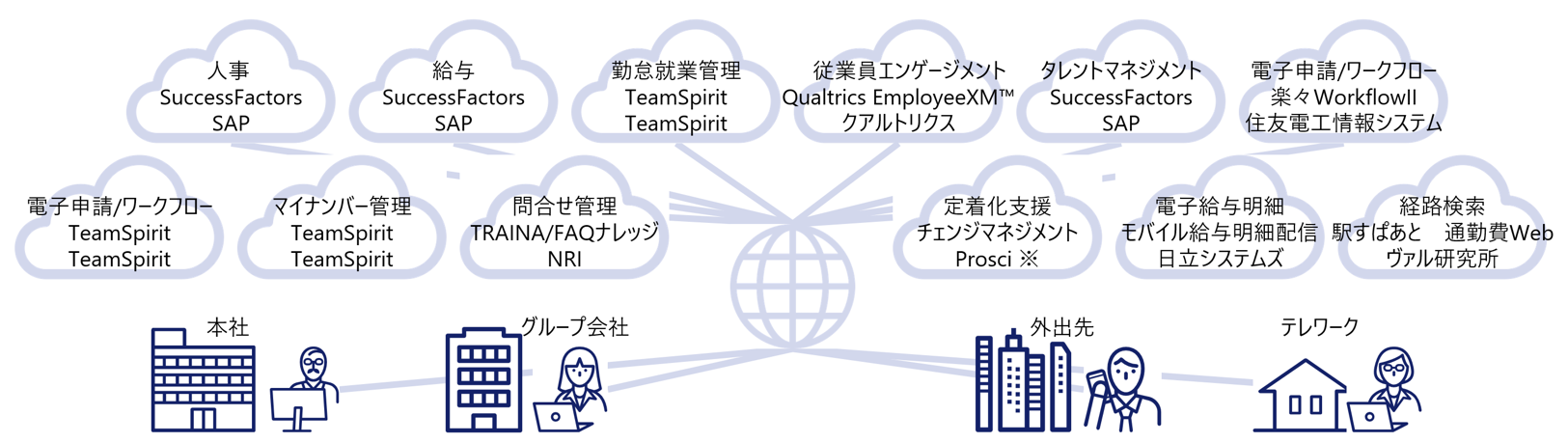
NRIでは、人事・給与をはじめ、勤怠・タレントマネジメント・そして従業員エンゲージメントと、各々最適なクラウドサービスを統合することで人事業務全般をサポートするトータルソリューションとしてサービスを提供している。
複数のクラウドサービスを透過的にデータ連携することで、例えば従業員エンゲージメントにおけるパルスサーベイの分析・評価に対して、従業員の属性・人事評価・勤務時間などといったオペレーショナルデータと関連付けることにより、よりきめ細かい対策を検討することが可能となる。
NRIでは、クラウド空間上にERPを実装し、様々なクラウドサービスと情報統合を行うサービス(マルチクラウド)を2015年より提供してきている。
マルチクラウドを活用することで、人事・労務に関連した制度・法改正への対応が、グループ一斉にワンストップで可能となる。これによってシステムの改修費および運用保守費の削減が期待出来る。また、従来型システムにありがちな、システム改修漏れや改修タイミングのずれが解消される。
言うまでもなく、セキュリティ対策についても万全を期している。
ERP人事ソリューションのマルチクラウドのイメージ(図4)
※Prosci社認定資格を有した日本アタウェイ社との協業によりご提供いたします。
- SAP、SAPロゴ、本リリースに記載されているすべてのSAP製品およびサービス名はドイツにあるSAP SE(または、SAP関連会社)やその他世界各国における登録商標または商標です。またその他記載された製品名やサービス名などは該当する各社の商標です。商標に関する詳しい情報や通知については、http://www.sap.com/trademarkをご覧ください。
- 「TeamSpirit」は株式会社チームスピリットの登録商標です。
- 「楽々Workflow」 は、住友電気工業株式会社の登録商標です。
- Prosci owns the following trademarks, service marks, and/or trade dress (collectively, and together with any additional trademarks, service marks, and/or trade dress that Prosci currently owns or later acquires, the "Prosci Trademarks"): PROSCI®
- 「株式会社日立システムズ」および「モバイル給与明細配信サービス」は、「株式会社日立システムズ」の登録商標または商標です。
- 「駅すぱあと」「ヴァル研究所」は株式会社ヴァル研究所の登録商標です。
NRIにおけるERP事業について

- 2010年12月「SAP HANA」の世界初の導入に成功
- 2015年3月「SAP AFS」を大手アパレルに向けにAWS上で実装し、世界最高性能を達成
- 2015年3月「SAP AWARD OF EXCELLENCE 2015(最優秀プロジェクト賞)を受賞
- 2016年4月「SAP S/4HANA Enterprise Management」が国内で初稼動

米SAPパロアルト研究所に常駐するNRI社員
SAP認定資格者数
NRIプロパー社員で約300名超のSAP認定資格者を有している。※のべ数、2018年8月現在
SAPアワード受賞実績
- SAPフォーカス・アワード(2011)
- ニュー・チャネル・グロース(2013)
- ザ・ベスト・HANA(2013)
- プロジェクト・オブ・ザ・イヤー最優秀PJ賞(2015) ※NEC様との共同受賞
- SAP S/4HANAドライブ・アワード(2016)
SAPグローバルでのアワード受賞実績
- 2016 SAP HANA Innovation Award “Honorable Mention”
主要導入実績
製薬メーカーを始めとする様々な製造業はもとより、サービス業全般(アパレル、商社、卸、流通小売、情報通信、不動産)にわたってS/4HANA、S&OP、SuccessFactorsその他の導入をご支援させていただきました。