医薬品、医療機器の研究・開発・製造にあたっては、文書管理業務に対して、単なるファイルの保存ではなく、文書の作成者、承認者を明確にすること、有効/無効を明確にすること、さらに長期間、改ざんの余地が無い状態で管理することが必須要件となっています。
Perma Document(GxP Edition)は、ER/ES指針や21 CFR Part 11等の規制に対応しており、医薬品業界で必要とされる機能を提供しています。また、CSV(コンピュータ化システムバリデーション)を支援する雛型文書のオプションも用意されており、スムーズかつ短期間での導入が可能です。
Perma Documentの特徴
- ER/ES指針、CSV、データインテグリティに対応しており、システムを持たない、作らない文書管理クラウドサービス
- GxPで文書/記録の保管が求められている業務に関する機能が豊富
- 関連文書や記録の検索が簡単で、無通告立入検査に柔軟に対応
- NRIが国内で開発・運用し、データも国内で管理しており、利用者の負担は月額利用料のみ
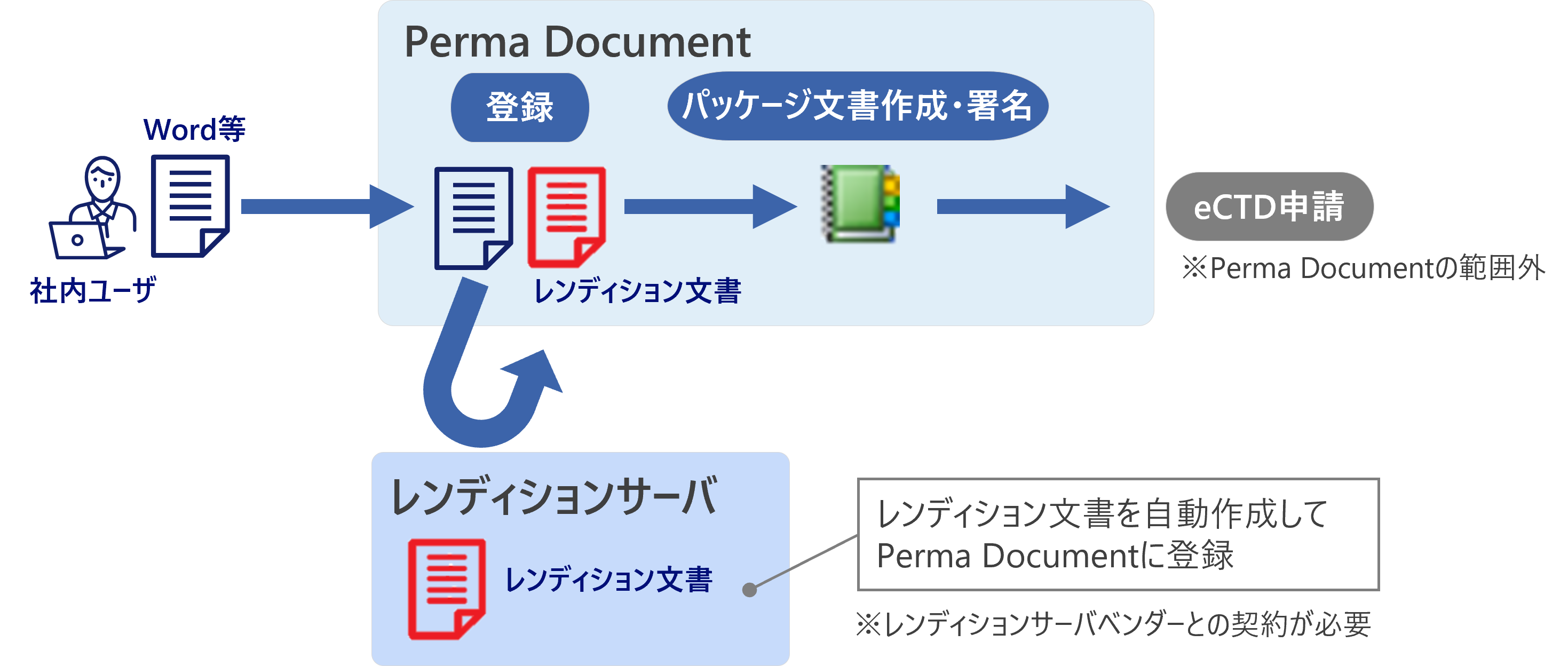
文書に関わる業務の全体像
機能一覧
-
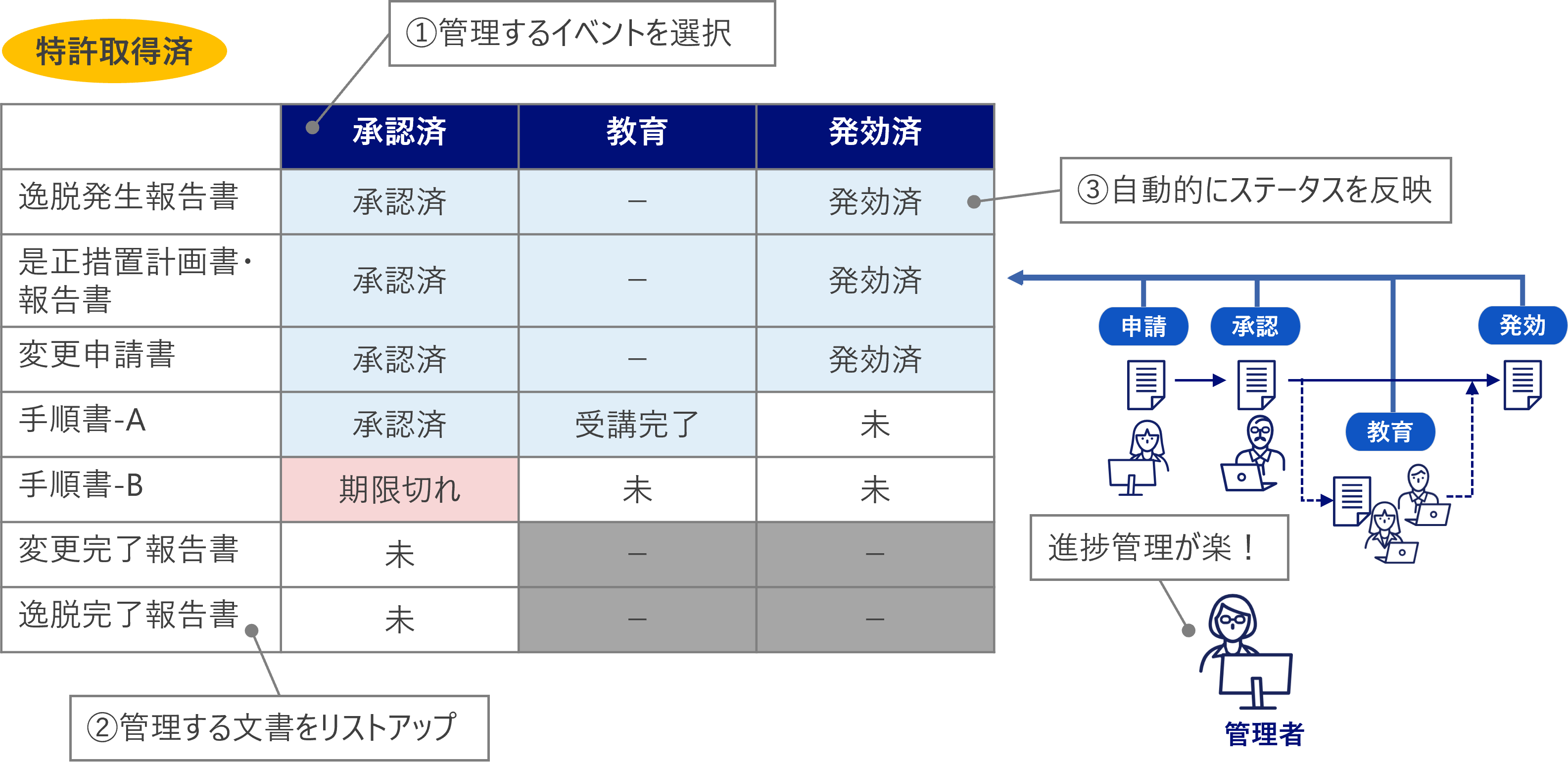
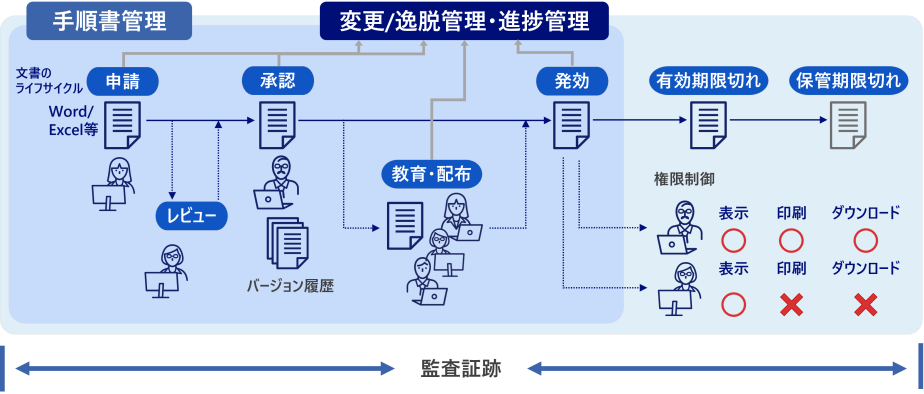
ライフサイクル管理 
-
上書き禁止制御
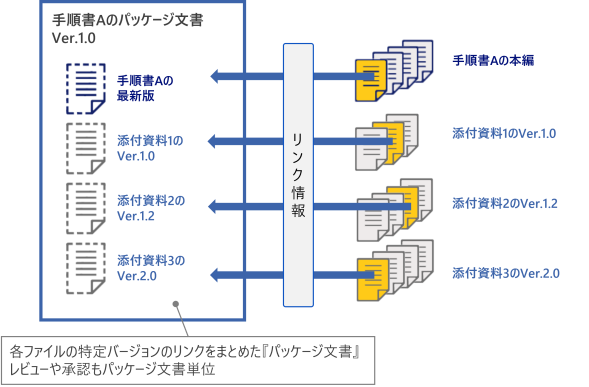
バージョン管理
-
ワークフロー・
電子署名
-
配布管理 
-
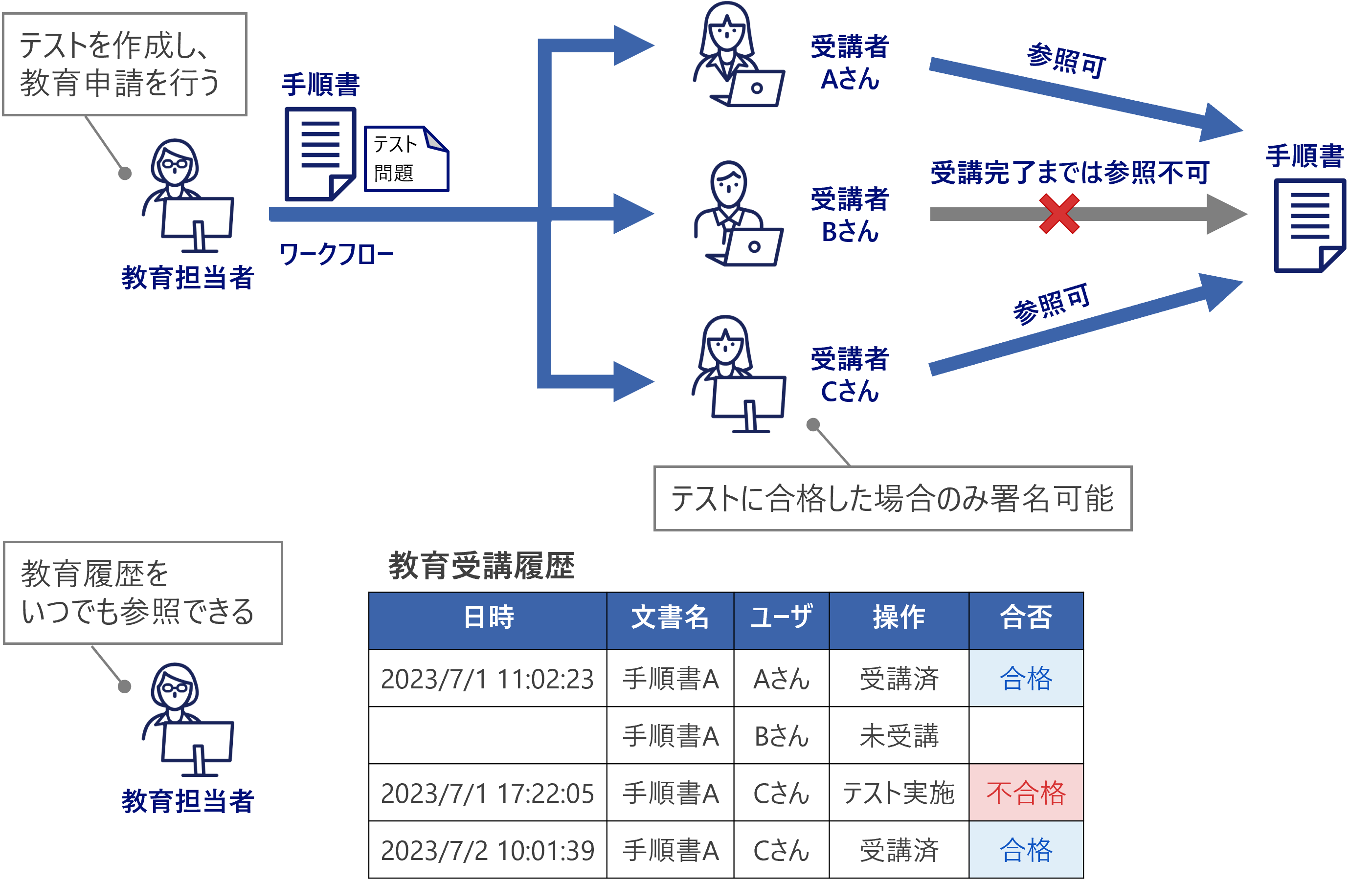
教育履歴管理 
-
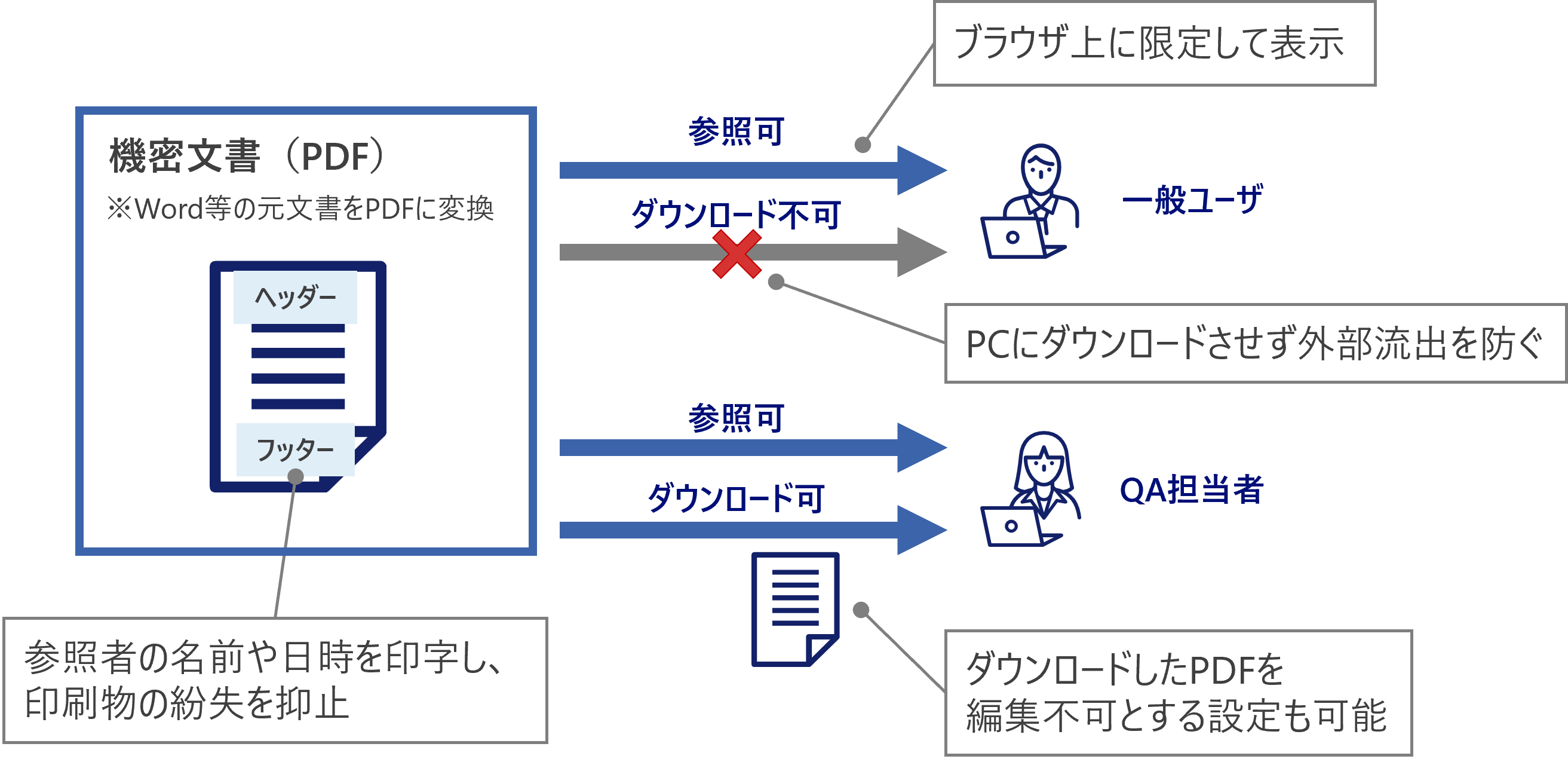
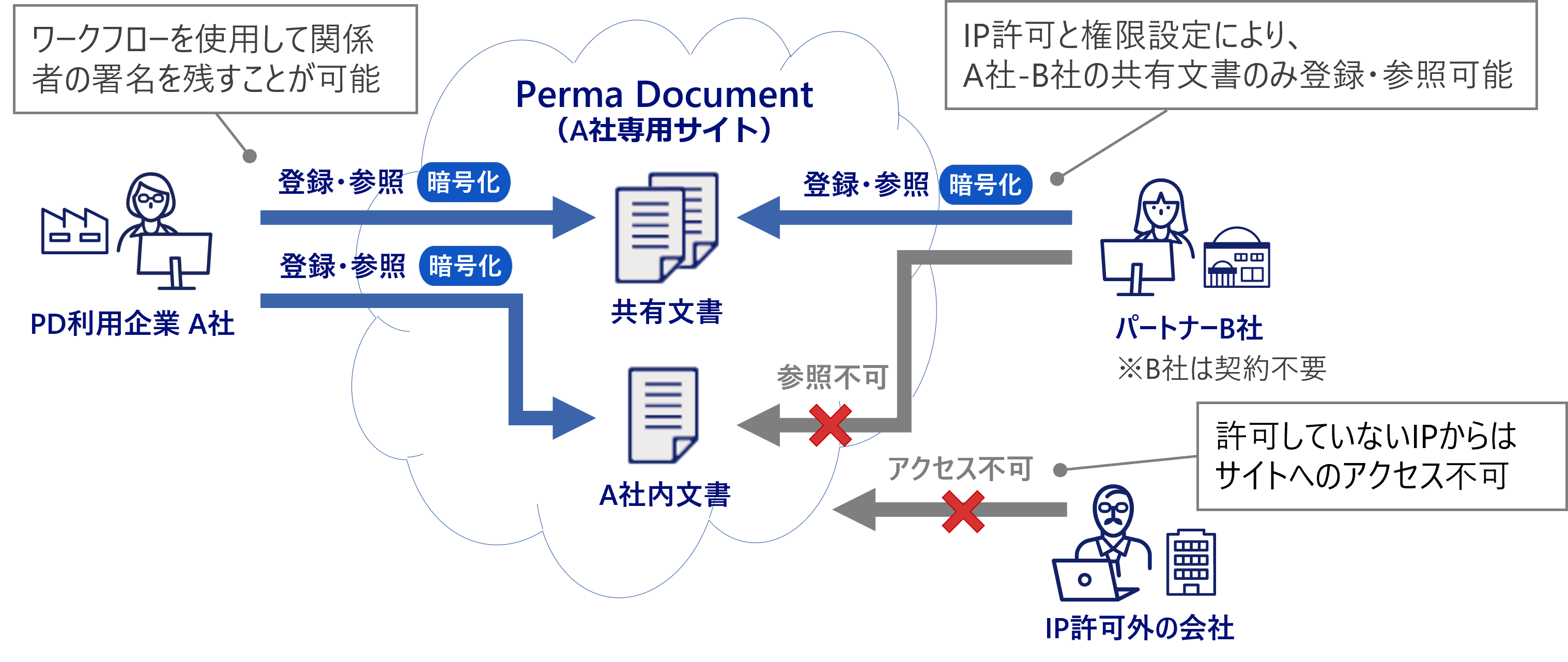
アクセス管理 
-
監査証跡 
-
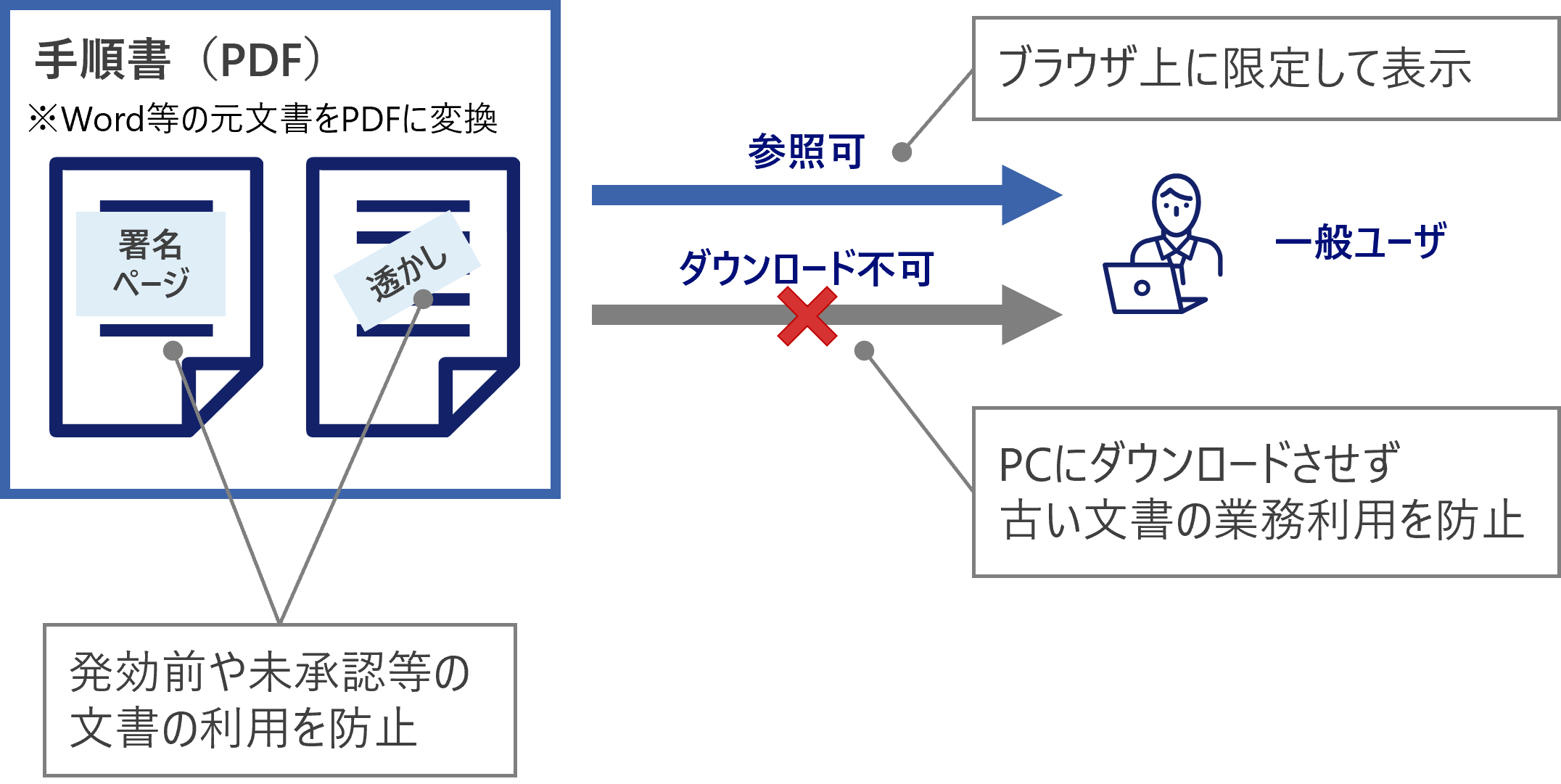
文書保護 
-
テーマ管理・
カスタム申請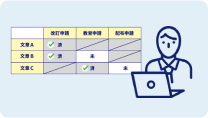
-
レンディション管理 
-
資格管理 
-
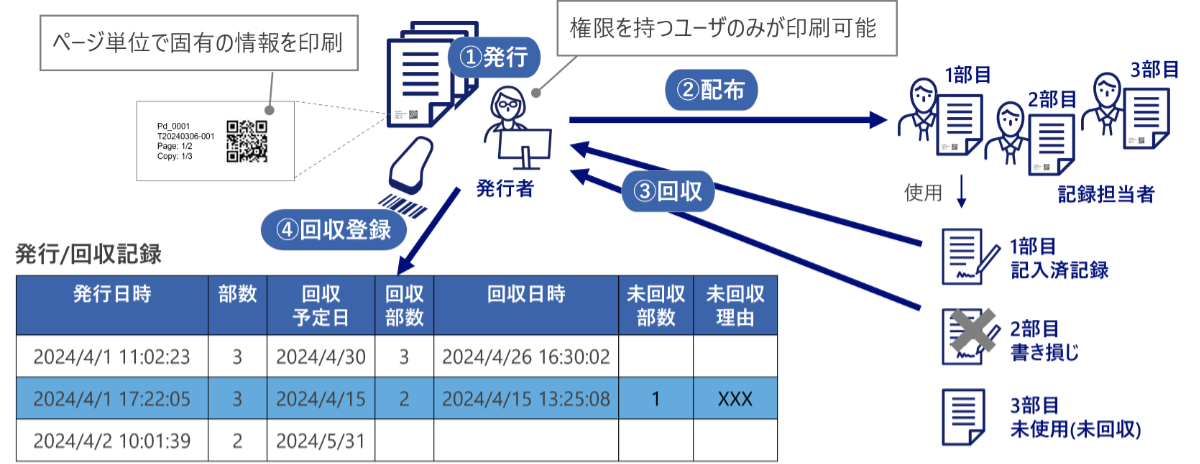
トレーサブル印刷 
- 文書のライフサイクル全体を適切に管理し、品質保証や改ざん防止が可能
- 手順書管理、進捗管理(不適合、変更、苦情処理等)を容易に実現
- 文書ごとに表示、印刷、ダウンロード等のアクセス制御も可能
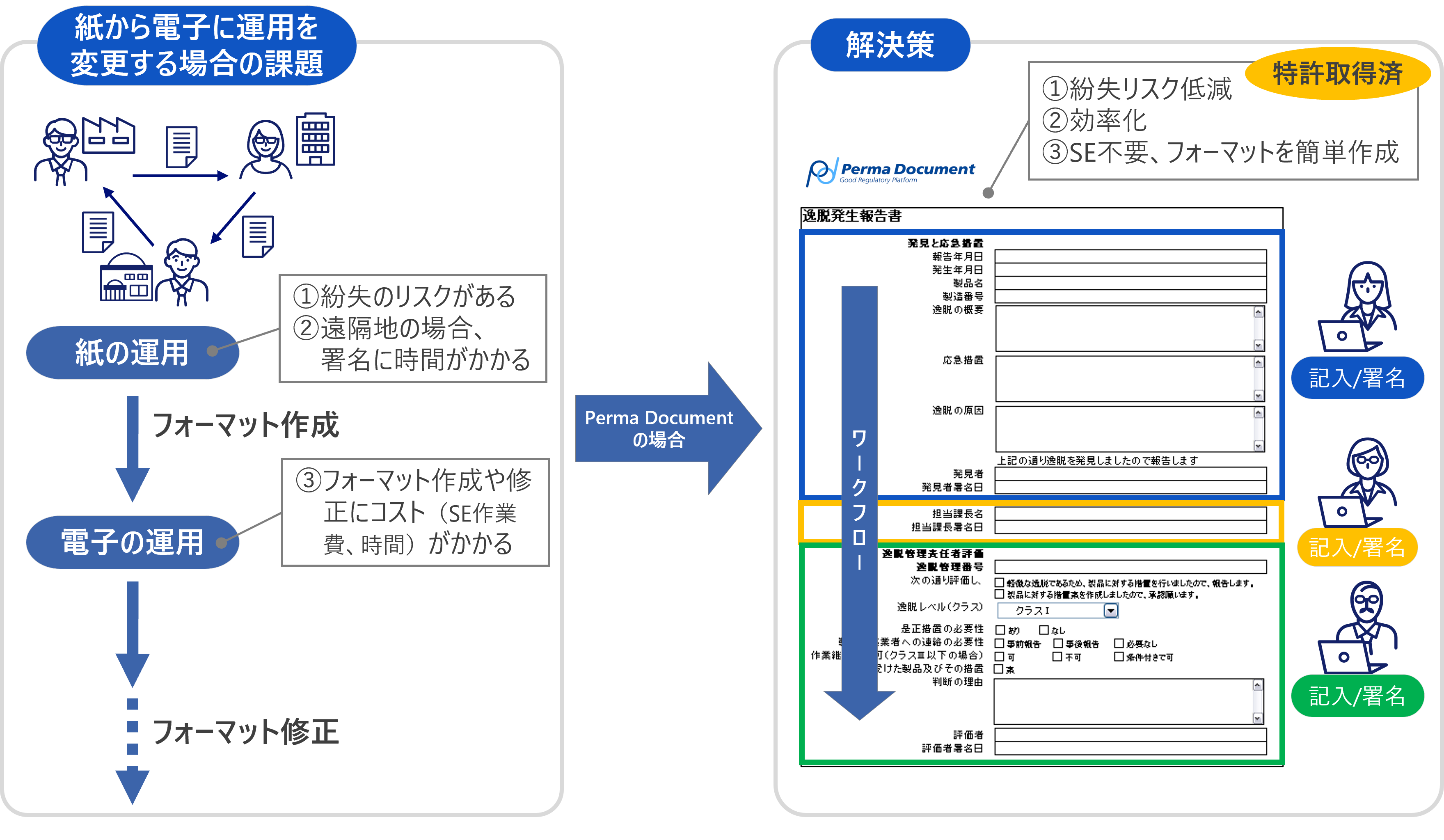
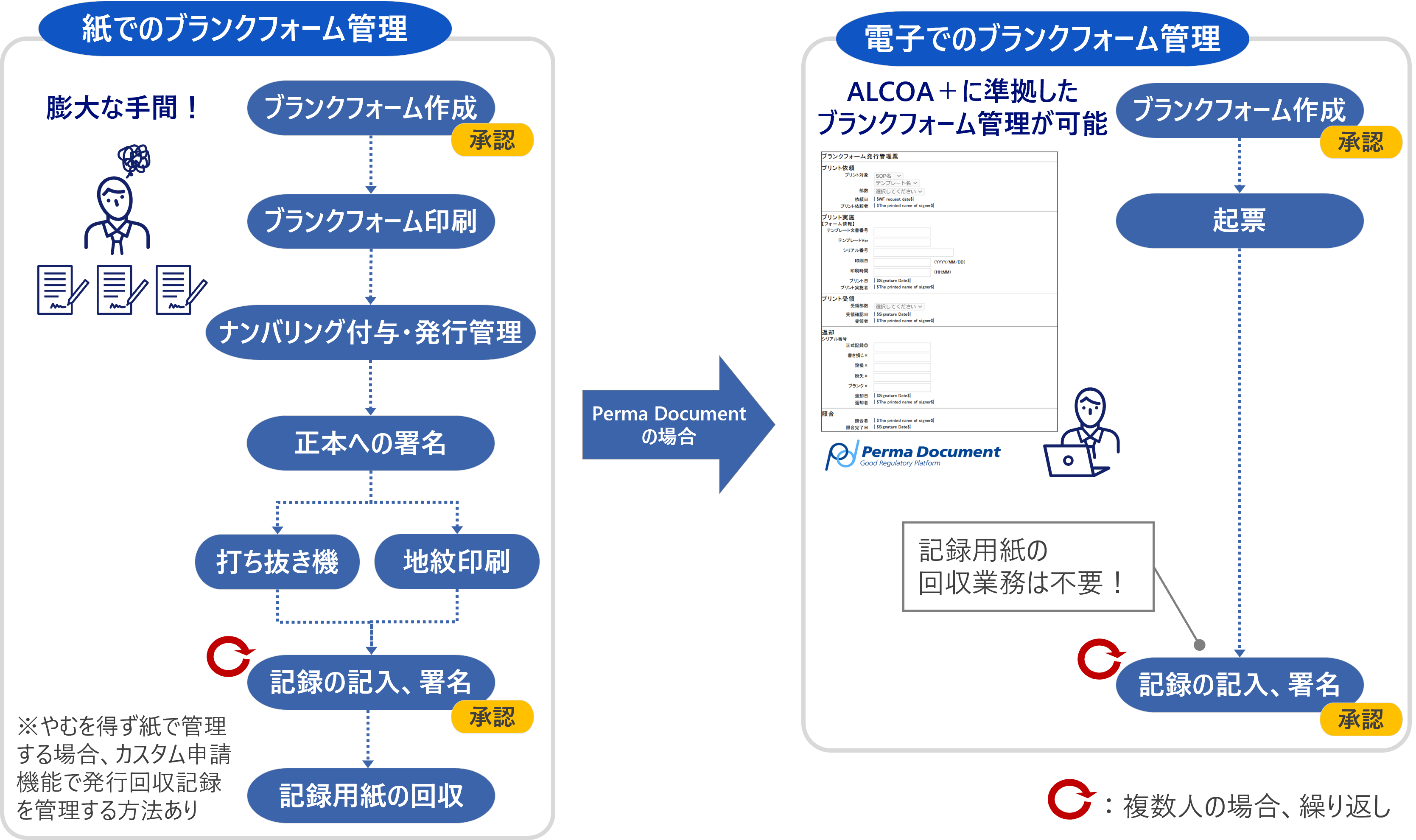
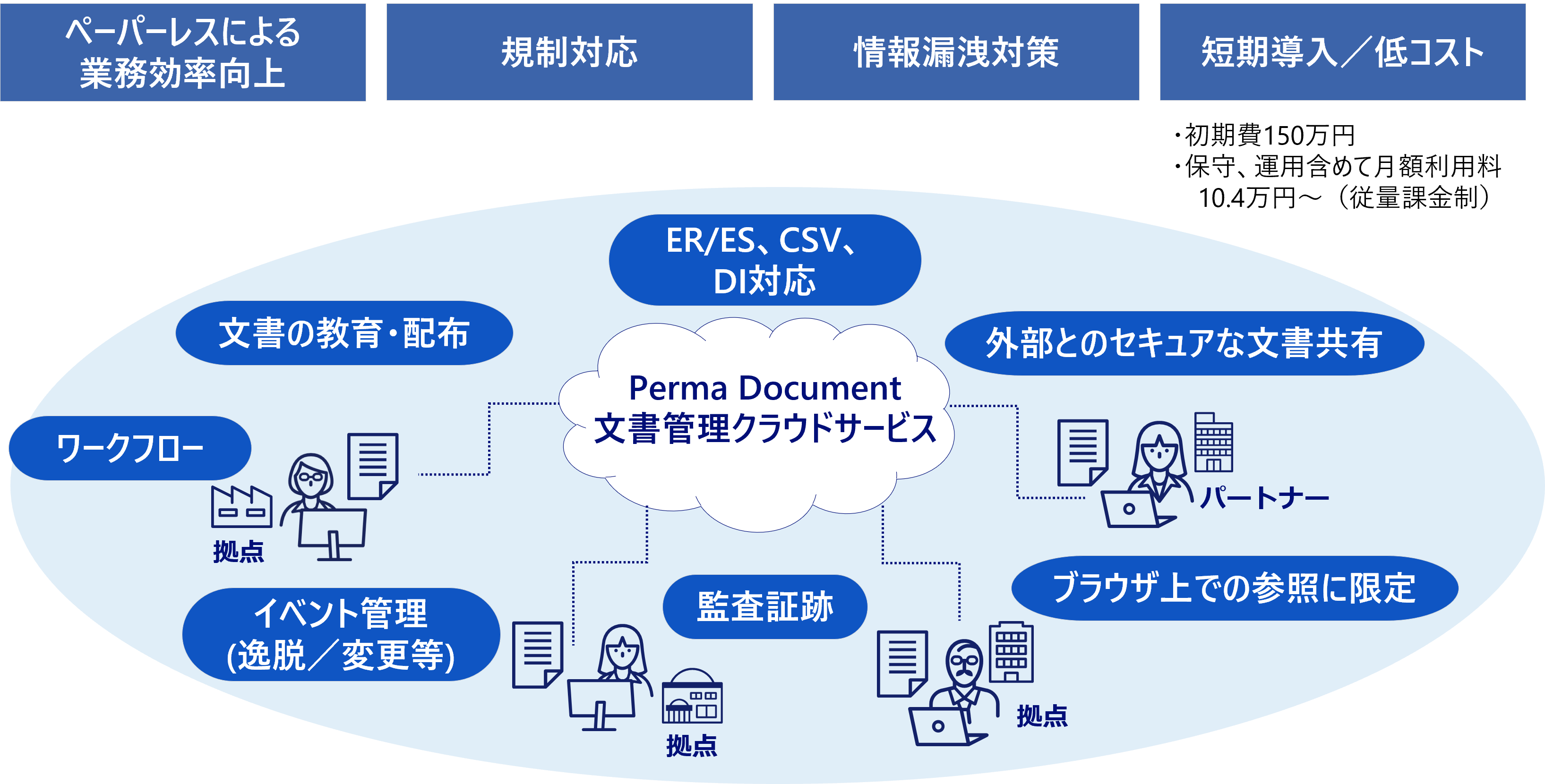
課題別利用シーン
文書管理業務におけるさまざまな課題を解決することができます。
- このようなシーンでご活用いただけます
利用料金
以下の料金体系でご利用いただけます。詳細は別途お見積りさせていただきます。
| 初期費用 | 150万円~ |
|---|---|
| 月額利用料 | 10万4,000円~ |
導入実績
- 企業数:60社
- ユーザー数:20,000ユーザー
(2023年4月時点)
運用保守サポート
- 24時間365日利用可能
- 万全のセキュリティ
- バックアップ、災害対策、障害対策
- ヘルプデスク(平日9:00~17:00)
開発背景
1997年、米国FDAが新薬の申請に関連する電子記録・電子署名を認める上で「21 CFR Part 11」を制定し、グローバルに各国が批准したため事実上のグローバル標準として浸透しました。「21 CFR Part 11」は、電子記録・電子署名のレギュレーションとして、その後の他の法制度に大きな影響を与えたと言われています。
| オーディットトレイル | 監査証跡 |
|---|---|
| セキュリティ・インテグリティ | 安全性・完全性 |
| コンピュータ・システム・バリデーション | システム妥当性検証 |
その後2000年代に入り、国内の製薬企業各社も同等のレギュレーションに対応し、電子化を進めていきました。その一方で、紙文書と比較すると、電子文書の完全性(改ざんがされていないこと)の証明に多くの手作業が発生し、効率性と非効率性という新たな矛盾を抱えていくこととなりました。さらに時代はインターネットの本格活用となり、製薬企業の開発プロセスもコラポレーションが進展していく一方で、電子文書の改ざん防止がネット活用における新たな課題となりました。
そうした製薬企業各社の声を受け、当時産業界で認知され始めたクラウドサービスによる提供を企画し、業界のさきがけとして2008年に電子文書管理クラウドサービス「Perma Document」が誕生しました。
NRIは製薬企業の電子文書管理に15年以上向き合い続け、GxPの文書管理業務のあるべき姿を確立しました。
- その他、品質保証が求められる業界の方
- Standard Edition